- تعداد بازدید : ۳۵۹ بار
منبع ترکیبات نیتروژن دار، نیتروژن موجود در جو است که توسط فرآیند تثبیت نیتروژن، مولکول نیتروژن به آمونیاک کاهیده میشود. آمونیاک حاصله به ترکیبهای نیتروژندار آلی تبدیل میگردد. به طور رسمی آمین ها مشتقات آمونیاک هستند، جایی که یک یا چند اتم هیدروژن با یک ماده جانبی مانند یک گروه آلکیل یا آریل جایگزین شده اند، به ترتیب می توان آن ها را آلکیل آمین و آریل آمین نامید. آمین هایی که هر دو نوع جایگزین به یک اتم نیتروژن متصل شوند، آلکیل آریل آمین نامیده می شوند. آمین های مهم شامل اسیدهای آمینه، آمین های بیوژنیک، تری متیل آمین و آنیلین هستند. به مشتقات غیر آلی آمونیاک آمین هایی مانند مونوکلرآمین (NClH۲) نیز گفته می شود. جایگزین NH۲ را یک گروه آمینه می نامند. همچنین به ترکیباتی با اتم نیتروژن متصل به یک گروه کربونیل، آمید گفته می شود که دارای خواص شیمیایی متفاوت از آمین هستند.
آمینها معمولاً از آمونیاک استخراج میشوند که جای هیدروژنها گروه آلکیلی قرار میگیرند. از دیگر آمینهای مهم آمینواسیدها نیز هستند. آمین هایی که به طور طبیعی وجود دارند، شامل آلکالوئیدهایی هستند که در گیاهان خاصی وجود دارند. انتقال دهنده های عصبی کاتکول آمین (به عنوان مثال دوپامین، اپی نفرین و نوراپی نفرین) و یک واسطه شیمیایی محلی، هیستامین، که در بیشتر بافت های حیوانات رخ می دهد.
طبقه بندی آمین ها:
آمین ها را می توان با توجه به ماهیت و تعداد جایگزین های موجود در نیتروژن طبقه بندی کرد.
آمین های آلیفاتیک: که فقط حاوی جایگزین های H و آلکیل هستند.
آمین های معطر: که دارای اتم نیتروژن متصل به یک حلقه معطر هستند.
آمین ها، آلکیل و آریل به طور یکسان، بر اساس تعداد اتم های کربن مجاور نیتروژن در سه گروه سازمان یافته اند. این ترکیبات آلی جزو بازها به شمار می روند و شامل یک اتم نیتروژن مرکزی و یک یا دو یا سه گروه آلکیل متصل به آن هستند، که به ترتیب آمین نوع یک، آمین نوع دو و آمین نوع سه نامگذاری میشوند :
آمین اولیه (۱ درجه)
آمین ثانویه (۲ درجه)
آمین سوم (۳ درجه)
آمین های اولیه (۱ درجه):
آمین های اولیه هنگامی به وجود می آیند که یکی از سه اتم هیدروژن موجود در آمونیاک توسط یک گروه آلکیل یا آمین معطر جایگزین شود. آمین های اولیه مهم شامل متیل آمین، بیشتر اسیدهای آمینه و عامل بافر هستند، در حالی که آمین های معطر اولیه شامل آنیلین هستند.
آمین های ثانویه (۲ درجه):
خاصیت بازی آمین نوع دوم از بقیه بیشتر بوده. آمین های ثانویه دارای دو جایگزین آلی (آلکیل، آریل یا هر دو) هستند، که همراه با یک هیدروژن به نیتروژن متصل می شوند. نمایندگان مهم شامل دی متیل آمین می باشند. در حالی که نمونه ای از یک آمین معطر می تواند دی فنیل آمین باشد.
آمین های سوم (۳ درجه):
در آمین های نوع سوم، نیتروژن دارای سه جایگزین آلی است. به عنوان مثال می توان به تری متیل آمین که بوی خاص ماهی دارد و EDTA اشاره کرد. زیرشاخه چهارم با اتصال جایگزین های متصل به نیتروژن تعیین می شود:
آمین های حلقوی یا آمین های ثانویه یا آمین نوع سوم هستند. نمونه هایی از آمین های حلقوی شامل حلقه آزیریدین ۳ عضوی وحلقه پیپریدین شش عضوی می باشد. همچنین وجود چهار جایگزین آلی روی نیتروژن امکان پذیر است. این گونه ها آمین نیستند، بلکه کاتیون های آمونیوم رباعی هستند و دارای یک مرکز نیتروژن باردار می باشند. نمک های آمونیوم کواترنر با انواع مختلفی از آنیون ها وجود دارد.
نامگذاری آمین ها:
آمین ها به چندین روش نامگذاری می شوند. به طور معمول، به این ترکیب پیشوند آمینو یا پسوند آمین داده می شود. پیشوند “N-” جایگزینی را روی اتم نیتروژن نشان می دهد. به یک ترکیب آلی با چندین گروه آمینه دی آمین، تری آمین ، تترا آمین و غیره گفته می شود.
برای مثال: آمین های پایین با پسوند آمین نامگذاری می شوند. مانند: متیل آمین و آمین های بالاتر دارای پیشوند آمینو به عنوان یک گروه عملکردی هستند. مانند ۲-آمینوپنتان.
ویژگی های آمین ها:
پیوند هیدروژنی به طور قابل توجهی بر خصوصیات آمین های اولیه و ثانویه تأثیر می گذارد. به عنوان مثال، متیل و اتیل آمین ها گازهای تحت شرایط استاندارد هستند، در حالی که الکل های متیل و اتیل مربوطه مایعات هستند. آمین ها دارای بوی مشخص آمونیاک و آمین های مایع دارای بوی مشخص ماهی هستند.
تولید آمین ها:
دو خاصیت ویژه آمینها، خاصیت بازی و خاصیت هستهدوستی می باشد، که هر دو از جفت الکترون غیرپیوندی ازت ناشی میشود. هنگامی که آمین به عنوان یک باز عمل می کند، این جفت الکترون، یک پروتون از اسید برونستد جذب میکنند. گاهی نیز این جفت الکترون غیرپیوندی به کربن قطبیشده بر روی مولکول الکتروندوست حمله می کنند و آمین به عنوان هستهدوست وارد واکنش میشود.
از واکنش آمونیاک و آلکیل هالیدها، طی یک واکنش SN۲، میتوان آمینهای مختلفی را تهیه نمود.
ساختار آلکیل آمین ها:
آمین های آلکیل به طور مشخص دارای مراکز نیتروژن چهار ضلعی هستند. زاویه های C-N-C و C-N-H به زاویه ایده آل ۱۰۹ درجه نزدیک می شوند. فواصل C-N کمی کوتاه تر از فواصل C-C هستند.
آمین های معطر:
در آمین های معطر (آنیلین)، نیتروژن به دلیل ترکیب شدن جفت تنها با جایگزین آریل، تقریباً مسطح است. فاصله C-N به ترتیب کوتاهتر است و فاصله C-N همان فاصله C-C است.
انواع آمین:
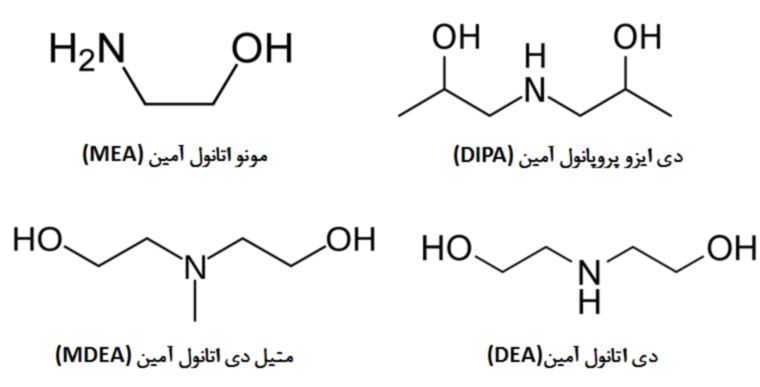
مونو اتانول آمین
دی اتانول آمین
تری اتانول آمین
مونو کلر و آمین
کاربرد آمین ها:
آنیلین، اتانول آمین ها و چندین آمین دیگر کالاهای عمده صنعتی هستند که در ساخت لاستیک ، رنگ ، داروها و رزین ها و الیاف مصنوعی و برای برنامه های کاربردی دیگر مورد استفاده قرار می گیرند. اسیدهای آمینه ترکیبات آلی هستند که با هم ترکیب می شوند و پروتئین ایجاد می کنند. اسیدهای آمینه و پروتئین ها عناصر سازنده زندگی هستند.
هنگام هضم یا تجزیه پروتئین ها، اسیدهای آمینه باقی می مانند. بدن انسان از اسیدهای آمینه برای ساخت پروتئین استفاده می کند.
آمین ها در رنگ ها، داروسازی و فرآوری گازها نیز مورد استفاده قرار می گیرند.
انواع اسیدهای آمینه:
اسیدهای آمینه ضروری: توسط بدن ساخته نمی شوند. در نتیجه، باید از مواد غذایی حاصل شوند. مانند: هیستیدین، ایزولوسین، لوسین، لیزین، متیونین، فنیل آلانین، ترئونین، تریپتوفان و والین.
اسیدهای آمینه غیر ضروری: غیر ضروری به این معنی است که بدن ما یک اسید آمینه تولید می کند که مرتبط با غذای مصرفی نیز نمی باشد. اسیدهای آمینه غیر ضروری عبارتند از: آلانین، آرژنین، آسپاراژین، اسید اسپارتیک، سیستئین، اسید گلوتامیک، گلوتامین و تیروزین.
اسیدهای آمینه شرطی: آمینو اسیدهای شرطی معمولاً ضروری نیستند، مگر در مواقع بیماری و استرس و عبارتند از: آرژنین، سیستئین، گلوتامین، تیروزین، گلیسین، اورنیتین، پرولین و سرین.
مشخصات اطلاعات شرکت فروشنده این محصول
منبع ترکیبات نیتروژن دار، نیتروژن موجود در جو است که توسط فرآیند تثبیت نیتروژن، مولکول نیتروژن به آمونیاک کاهیده میشود. آمونیاک حاصله به ترکیبهای نیتروژندار آلی تبدیل میگردد. به طور رسمی آمین ها مشتقات آمونیاک هستند، جایی که یک یا چند اتم هیدروژن با یک ماده جانبی مانند یک گروه آلکیل یا آریل جایگزین شده اند، به ترتیب می توان آن ها را آلکیل آمین و آریل آمین نامید. آمین هایی که هر دو نوع جایگزین به یک اتم نیتروژن متصل شوند، آلکیل آریل آمین نامیده می شوند. آمین های مهم شامل اسیدهای آمینه، آمین های بیوژنیک، تری متیل آمین و آنیلین هستند. به مشتقات غیر آلی آمونیاک آمین هایی مانند مونوکلرآمین (NClH۲) نیز گفته می شود. جایگزین NH۲ را یک گروه آمینه می نامند. همچنین به ترکیباتی با اتم نیتروژن متصل به یک گروه کربونیل، آمید گفته می شود که دارای خواص شیمیایی متفاوت از آمین هستند.
آمینها معمولاً از آمونیاک استخراج میشوند که جای هیدروژنها گروه آلکیلی قرار میگیرند. از دیگر آمینهای مهم آمینواسیدها نیز هستند. آمین هایی که به طور طبیعی وجود دارند، شامل آلکالوئیدهایی هستند که در گیاهان خاصی وجود دارند. انتقال دهنده های عصبی کاتکول آمین (به عنوان مثال دوپامین، اپی نفرین و نوراپی نفرین) و یک واسطه شیمیایی محلی، هیستامین، که در بیشتر بافت های حیوانات رخ می دهد.
طبقه بندی آمین ها:
آمین ها را می توان با توجه به ماهیت و تعداد جایگزین های موجود در نیتروژن طبقه بندی کرد.
آمین های آلیفاتیک: که فقط حاوی جایگزین های H و آلکیل هستند.
آمین های معطر: که دارای اتم نیتروژن متصل به یک حلقه معطر هستند.
آمین ها، آلکیل و آریل به طور یکسان، بر اساس تعداد اتم های کربن مجاور نیتروژن در سه گروه سازمان یافته اند. این ترکیبات آلی جزو بازها به شمار می روند و شامل یک اتم نیتروژن مرکزی و یک یا دو یا سه گروه آلکیل متصل به آن هستند، که به ترتیب آمین نوع یک، آمین نوع دو و آمین نوع سه نامگذاری میشوند :
آمین اولیه (۱ درجه)
آمین ثانویه (۲ درجه)
آمین سوم (۳ درجه)
آمین های اولیه (۱ درجه):
آمین های اولیه هنگامی به وجود می آیند که یکی از سه اتم هیدروژن موجود در آمونیاک توسط یک گروه آلکیل یا آمین معطر جایگزین شود. آمین های اولیه مهم شامل متیل آمین، بیشتر اسیدهای آمینه و عامل بافر هستند، در حالی که آمین های معطر اولیه شامل آنیلین هستند.
آمین های ثانویه (۲ درجه):
خاصیت بازی آمین نوع دوم از بقیه بیشتر بوده. آمین های ثانویه دارای دو جایگزین آلی (آلکیل، آریل یا هر دو) هستند، که همراه با یک هیدروژن به نیتروژن متصل می شوند. نمایندگان مهم شامل دی متیل آمین می باشند. در حالی که نمونه ای از یک آمین معطر می تواند دی فنیل آمین باشد.
آمین های سوم (۳ درجه):
در آمین های نوع سوم، نیتروژن دارای سه جایگزین آلی است. به عنوان مثال می توان به تری متیل آمین که بوی خاص ماهی دارد و EDTA اشاره کرد. زیرشاخه چهارم با اتصال جایگزین های متصل به نیتروژن تعیین می شود:
آمین های حلقوی یا آمین های ثانویه یا آمین نوع سوم هستند. نمونه هایی از آمین های حلقوی شامل حلقه آزیریدین ۳ عضوی وحلقه پیپریدین شش عضوی می باشد. همچنین وجود چهار جایگزین آلی روی نیتروژن امکان پذیر است. این گونه ها آمین نیستند، بلکه کاتیون های آمونیوم رباعی هستند و دارای یک مرکز نیتروژن باردار می باشند. نمک های آمونیوم کواترنر با انواع مختلفی از آنیون ها وجود دارد.
نامگذاری آمین ها:
آمین ها به چندین روش نامگذاری می شوند. به طور معمول، به این ترکیب پیشوند آمینو یا پسوند آمین داده می شود. پیشوند “N-” جایگزینی را روی اتم نیتروژن نشان می دهد. به یک ترکیب آلی با چندین گروه آمینه دی آمین، تری آمین ، تترا آمین و غیره گفته می شود.
برای مثال: آمین های پایین با پسوند آمین نامگذاری می شوند. مانند: متیل آمین و آمین های بالاتر دارای پیشوند آمینو به عنوان یک گروه عملکردی هستند. مانند ۲-آمینوپنتان.
ویژگی های آمین ها:
پیوند هیدروژنی به طور قابل توجهی بر خصوصیات آمین های اولیه و ثانویه تأثیر می گذارد. به عنوان مثال، متیل و اتیل آمین ها گازهای تحت شرایط استاندارد هستند، در حالی که الکل های متیل و اتیل مربوطه مایعات هستند. آمین ها دارای بوی مشخص آمونیاک و آمین های مایع دارای بوی مشخص ماهی هستند.
تولید آمین ها:
دو خاصیت ویژه آمینها، خاصیت بازی و خاصیت هستهدوستی می باشد، که هر دو از جفت الکترون غیرپیوندی ازت ناشی میشود. هنگامی که آمین به عنوان یک باز عمل می کند، این جفت الکترون، یک پروتون از اسید برونستد جذب میکنند. گاهی نیز این جفت الکترون غیرپیوندی به کربن قطبیشده بر روی مولکول الکتروندوست حمله می کنند و آمین به عنوان هستهدوست وارد واکنش میشود.
از واکنش آمونیاک و آلکیل هالیدها، طی یک واکنش SN۲، میتوان آمینهای مختلفی را تهیه نمود.
ساختار آلکیل آمین ها:
آمین های آلکیل به طور مشخص دارای مراکز نیتروژن چهار ضلعی هستند. زاویه های C-N-C و C-N-H به زاویه ایده آل ۱۰۹ درجه نزدیک می شوند. فواصل C-N کمی کوتاه تر از فواصل C-C هستند.
آمین های معطر:
در آمین های معطر (آنیلین)، نیتروژن به دلیل ترکیب شدن جفت تنها با جایگزین آریل، تقریباً مسطح است. فاصله C-N به ترتیب کوتاهتر است و فاصله C-N همان فاصله C-C است.
انواع آمین:
مونو اتانول آمین
دی اتانول آمین
تری اتانول آمین
مونو کلر و آمین
کاربرد آمین ها:
آنیلین، اتانول آمین ها و چندین آمین دیگر کالاهای عمده صنعتی هستند که در ساخت لاستیک ، رنگ ، داروها و رزین ها و الیاف مصنوعی و برای برنامه های کاربردی دیگر مورد استفاده قرار می گیرند. اسیدهای آمینه ترکیبات آلی هستند که با هم ترکیب می شوند و پروتئین ایجاد می کنند. اسیدهای آمینه و پروتئین ها عناصر سازنده زندگی هستند.
هنگام هضم یا تجزیه پروتئین ها، اسیدهای آمینه باقی می مانند. بدن انسان از اسیدهای آمینه برای ساخت پروتئین استفاده می کند.
آمین ها در رنگ ها، داروسازی و فرآوری گازها نیز مورد استفاده قرار می گیرند.
انواع اسیدهای آمینه:
اسیدهای آمینه ضروری: توسط بدن ساخته نمی شوند. در نتیجه، باید از مواد غذایی حاصل شوند. مانند: هیستیدین، ایزولوسین، لوسین، لیزین، متیونین، فنیل آلانین، ترئونین، تریپتوفان و والین.
اسیدهای آمینه غیر ضروری: غیر ضروری به این معنی است که بدن ما یک اسید آمینه تولید می کند که مرتبط با غذای مصرفی نیز نمی باشد. اسیدهای آمینه غیر ضروری عبارتند از: آلانین، آرژنین، آسپاراژین، اسید اسپارتیک، سیستئین، اسید گلوتامیک، گلوتامین و تیروزین.
اسیدهای آمینه شرطی: آمینو اسیدهای شرطی معمولاً ضروری نیستند، مگر در مواقع بیماری و استرس و عبارتند از: آرژنین، سیستئین، گلوتامین، تیروزین، گلیسین، اورنیتین، پرولین و سرین.
مشخصات اطلاعات شرکت فروشنده این محصول














